3.5 ARTÍCULO: “PANCREATITIS AGUDA Y SU
NUTRICIÓN”
Por: L.N. ADRIANA IMELDA GONZALEZ ACUÑA
Por: L.N. ADRIANA IMELDA GONZALEZ ACUÑA
La
pancreatitis aguda es proceso inflamatorio agudo del páncreas reversible que
puede comprometer por contigüidad estructuras vecinas e incluso desencadenar
disfunción de órganos y sistemas distantes.
Las
causas frecuentes
|
||
Litiasis
biliar 40%
|
||
Alcohol 30%
|
||
Idiopática
15%
|
||
Metabólica
5%
|
||
Fuente: Causa
de Pancreatitis.
La
mayoría son enzimas líticas que se secretan como precursores inactivos, los
cuales junto con inhibidores enzimáticos presentes en el jugo pancreático,
protegen al páncreas de su autodigestión. El páncreas normalmente secreta: Tripsina,
quimotripsina, amilasas, lipasas, elastasas, carboxipeptidasa A y B.
Los
eventos iniciales de la Pancreatitis Aguda son los siguientes:
o
El
aumento de la presión intraductal en el sistema excretor pancreático (litiasis
biliar).
o
Reflujo
de bilis al Wirsung.
o
Hipertrigliceridemia
aguda o preexistente.
o
Daño
isquémico.
o
Disrupción
de algún conducto excretor (trauma).
Fisiopatología en Pancreatitis aguda y litiasis biliar
Es
más frecuente en:
o
Cálculos
vesiculares pequeños,
o Coledocolitiasis,
o Conducto cístico ancho,
o Conducto biliopancreaticas distal
común. Inicia por la obstrucción del conducto pancreático:
o
Cálculo
en la ampolla de Váter, aunque sea una obstrucción transitoria con aumento de
la presión intraductal, reflujo biliar a los conductos pancreáticos y eventual
contaminación bacteriana por este mecanismo.
Fisiopatología en Pancreatitis aguda y alcohol
La
ingesta alcohólica excesiva. Si bien el primer episodio puede ser de gravedad,
las crisis posteriores son clínicamente menos importantes y que llevan al
cuadro de la pancreatitis crónica recurrente. Posterior a una ingesta masiva
alcohólica-alimentaria (que se asocia a una hipertrigliceridemia aguda), se
presentan con una P.A. de evolución muy grave.
Fisiopatología en Pancreatitis aguda por trauma
Diversas
cirugías abdominales pueden acompañarse de una discreta hiperamilasemia sin
otra evidencia de P.A. Por compromiso directo del páncreas o de su irrigación,
en cirugías extrabiliares o pancreáticas. En trauma directo. Por compromiso
obstructivo del sistema excretor pancreático, en cirugías biliares o
post-colangiopancreatografía retrógrada endoscópica.
SÍNTOMAS
Sintomas de la pancreatitis
|
Dolor abdominal súbito o intenso
del 85 al 100%
|
Náuseas y vómito del 54 al 92%
|
Anorexia del 83%
|
Masa abdominal del 6 al 20%
|
Íleo del 50 al 80%
|
Fiebre del 12 al 80%
|
Fuente:
síntomas más comunes en la pancreatitis
COMPLICACIONES
Complicaciones
Locales
|
Complicaciones
Sistémicas
|
Fuente: Complicaciones
de la Pancreatitis Crónica.
TRATAMIENTO
MÉDICO
Tratamiento farmacológico:
§
Pueden
ser indicados específicamente en las P.A. biliares.
§
Infección
de la necrosis pancreática,
Tratamiento
quirúrgico:
Tratamiento
de complicaciones locales:
Necrosis infectada:
TRATAMIENTO NUTRICIONAL
Lo más esencial para esta patología
por lo tanto se menciona los objetivos y la dietoterapia para mejorar la
calidad de vida y la sintomatología y así poder evitar las complicaciones.
Objetivos nutricionales
DIETOTERAPIA
En tiempo no agudo:
Se dará por fase la nutrición al
paciente:
o
Primera fase: Líquidos sin grasas, como infusiones
sin azúcar, agua y caldos vegetales desgrasados.
o
Segunda fase: Incorporación de hidratos de carbono:
Papas, arroz, pastas, purés de frutas no ácidas y pan tostado.
o
Tercera fase: Introducción progresiva de proteínas
animales: 50 gr en la comida y otro tanto en la cena, utilizando las más
digeribles (pescado)
o
Cuarta fase: Uso de grasas. Y finalmente:
Proteínas a 100 gr. Con verduras cocidas, para introducir primero carne de
pollo y carnes rojas.
En
casos graves de pancreatitis la nutrición será:
o
Sonda
nasoyeyunal o yeyunostomia.
o
Dieta
elemental.
·
La
dieta debe de carecer de grasa o contener ácidos grasos esenciales como Omega
3.
·
L-aminoácidos,
·
Alta
cantidad de glucosa
·
Cubrir
requerimientos de agua.
·
Electrolitos,
oligoelementos y vitaminas.
·
Ser
hiperosmolar y con un pH superior a 5.
ALIMENTOS NO RECOMENDADOS
Alimentos
colecistoquinéticos: crema,
mantequilla, manteca, tocino, frituras, vísceras, hígado, chorizo, longaniza,
quesos grasosos (amarillo, manchego, chihuahua, crema y doble crema) mariscos,
yema de huevo, leche entera, carne de cerdo, sesos, frutas secas grasosas,
Carnitas, aguacate etc.
Alimentos
meteorizantes: Plátano,
pepino, sandías, melón, uva, tunas, repollo, rábanos, coliflor, cebolla, ajo,
pimentón, habas
Estimulantes
gástricos: Menta,
pimienta negra
EDUCACIÓN
AL PACIENTE Y MEDIDAS HIGIÉNICAS
3.6 ARTÍCULO: “HEPATITIS AGUDA Y SU NUTRICIÓN”
La hepatitis es un trastorno hepático que
implica un proceso infamatorio causado por necrosis de las células hepáticas.
La
hepatitis viral puede ser aguda o crónica.
1.
Aguda: La hepatitis dura dos semanas y luego
se recupera.
2.
Crónica: Significa que el hígado puede estar
inflamado durante seis meses o más.
Causantes de las hepatitis virales:
|
VHA (antes hepatitis infecciosa o de corta duración).
|
VHB (antes hepatitis sérica o de larga incubación).
|
VHC (variante de la hepatitis no A – no B, o hepatitis
de transfusión).
|
VHD (agente delta vinculado con el de HVB).
|
VHE (variante de la hepatitis no A – no B, causante de
hepatitis epidémica en países en vías de desarrollo).
|
La hepatitis F es extremadamente rara y no se sabe
mucho sobre ella.
|
Virus de Epstein-Barr (Mononeuclosis Infecciosa)
|
CMV (Citomegalovirus).
|
Virus del Herpes simple.
|
Virus de la Rubeola.
|
Virus de la fiebre Amarilla.
|
Fuente: Tipos de
Hepatitis Víricas
Causantes de la Hepatitis
Tóxica:
|
o Fármacos.
|
o Venenos.
|
o Toxinas
|
Fuente: Tipos de
Hepatitis Tóxicas
En
circunstancias normales, no hay constancia de que ninguno de los virus de la
hepatitis sea directamente citopático para los hepatocitos. Los datos
disponibles sugieren que las manifestaciones clínicas y la evolución que siguen
a la lesión hepática aguda propia de una hepatitis vírica son determinadas por
las respuestas inmunitarias del paciente.
SÍNTOMAS
Más
especifico los síntomas por tipo de hepatitis:
TIPO
|
TIPO
DE VIRUS
|
TRANSMISIÓN
|
SÍNTOMAS
|
A
|
PICORNAVIRUS
|
ORAL Y SEXUAL
|
Náuseas, Vómitos, Fiebre
Pérdida del apetito y anorexia
Fatiga, Prurito , Excremento de
color claro Dolor abdominal
|
B
|
HEPADNAVIRUS
|
ORAL , PERCUTANEA, SEXUAL, PERINATAL
|
Fatiga, Náuseas, Fiebre baja.
Pérdida del apetito, Dolor muscular
y de estómago, Diarrea, Dolor de cabeza, Coluria u oscurecimiento de la
orina. Acolia o deposiciones de color claro. Ictericia
|
C
|
FLAVIVIRUS
|
PERCUTANEA Y PERINATAL
|
Cansancio, Náuseas, Prurito,
Fiebre,
Pérdida
del apetito, Sensación de dolor en la zona hepática, Diarrea, Tos seca
Oscurecimiento de la orina. Excrementos de color claro. Ictericia
|
D
|
VIRUS DEFECTIVE
|
PERCUTANEA Y SEXUAL
|
No
se conocen aun los síntomas que pueda causar
|
E
|
NO CLASIFICADO
|
ORAL
|
No
se conocen aun los síntomas que pueda causar
|
Fuente: Tipos de
Hepatitis. http://es.wikipedia.org.
Algunas hepatitis
agudas pueden cronificarse, algunos menos frecuentemente pueden producir un
Fallo Hepático Agudo o Masivo y otras evolucionan hacia la curación.
TRATAMIENTO NUTRICIONAL
Lo más esencial para esta patología por lo tanto se
menciona los objetivos y la dietoterapia para mejorar la calidad de vida y la
sintomatología y así poder evitar las complicaciones.
Objetivos nutricionales
DIETOTERAPIA
Para
el paciente de cualquier forma de Hepatitis debe tener una dieta completa y equilibrada. Es necesario
el apoyo nutricional.
o
El
beta caroteno es menos toxico y ofrece protección antioxidante.
ALIMENTOS NO RECOMENDADOS
Alimentos
ricos en vitamina A: Hígado,
Aceite de hígado de bacalao, Margarina, Paté de hígado, Mantequilla, Queso
graso, Huevos, Caviar, Nata, Pez espada,
Mango, Queso Cammembert, Riñón de cordero, Almejas, Quesos curados.
ALIMENTOS
RECOMENDADOS
Alimentos ricos en betacarotenos
Verdolaga, espinacas,
zanahoria, berros, albahaca, calabaza,
tomates, brócoli, acelgas.
Alimentos ricos en
zinc: Ostras, germen
de trigo, leche de vaca desnatada, bistec de ternera, camarón, cangrejos,
lentejas, soya en grano, sardinas
Alimentos ricos en
vitamina C: Leche,
yogurt, pierna de pollo, salchichas, salmón, merluza, brócoli, espinacas, col,
Kiwi, limón, naranja, frambuesa, semillas de calabaza, pistaches, castañas,
soya germinada.
EDUCACIÓN
AL PACIENTE Y MEDIDAS HIGIÉNICAS
La hepatitis se puede evitar.
Aquellos que están expuestos a la
sangre en su sitio de trabajo:
3.7 ARTÍCULO: “METABOLISMO DE LAS
PROTEÍNAS”
PROTEÍNAS
Las proteínas son macromoléculas
constituidas a partir de aminoácidos que desempeñan diferentes funciones, todas
ellas de gran importancia en los seres vivos.
Su nombre alude precisamente a esta característica (“proteos”: primera
categoría). Se encuentran en gran cantidad en cualquier tipo de de organismo,
representando aproximadamente la mitad del peso seco en las células.
Los aminoácidos son moléculas de bajo
peso molecular con una parte común, la agrupación alfa-amino-carboxilo, y otras
variables, de gran diversidad. Además del carbono, el hidrogeno y el oxigeno,
los aminoácidos contienen nitrógeno en su grupo amino. Aparte de su
contribución a la estructura y función de los aminoácidos, este nitrógeno es la
fuente de todos los grupos nitrogenados del resto de las moléculas biológicas
en el organismo humano. Algunos aminoácidos también contienen azufre en su
molécula.
Los aminoácidos son frecuentes que se
unan entre sí, formando un enlace de amida entre un grupo carboxilo y un grupo
amino. Este enlace recibe el nombre de enlace
peptídicos denominándose péptidos los
compuestos resultantes. El nombre de oligopeptidos
se emplea para designar los péptidos constituidos por pocos aminoácidos
(generalmente menos de 10), llamándose polipéptidos los constituidos por mas
aminoácidos. El nombre de proteínas
se reserva para los polipéptidos de gran peso molecular y que tienen una
conformación espacial determinada.
FUNCIONES
Existen 20 aminoácidos que entran a
formar parte de las proteínas (aminoácidos proteinogenos). Ello le permite que
existan posibilidades prácticamente infinitas de polímeros diversos.
Por consiguiente, las proteínas pueden
desempeñar una gran multiplicidad de funciones entre las que podemos destacar:
Fuente: “Instituto Chileno de Medicina”.
http://www.infojoven.cl
AMINOÁCIDOS
Los aminoácidos son las unidades
estructurales de las proteínas. Todos estos son compuestos que tienen un grupo
carboxilo y un grupo amino unidos por el mismo carbono (carbono alfa). El grupo
carboxilo y el grupo amino pueden tener una carga neta, negativa o positiva de
acuerdo con el pH del medio. Al pH fisiológico, la carga neta de loa
aminoácidos que no tengan otros grupos ionizables en su molécula se acerca a
cero.
El carbono alfa esta unido en casi
todos los aminoácidos (excepto la glicina) a 4 sustituyentes distintos (grupo
carboxilo, grupo amino, hidrogeno, y el radical característico de cada
aminoácido: R) en estos casos se trata de un carbono asimétrico que puede dar
lugar a dos serie de isómeros, de acuerdo con la posición de dichos
sustituyentes. Los aminoácidos proteinogenos son toda la serie L. Por eso se
les habla de ellos como L-alfa-aminoácidos.
Existen varios aminoácidos pero solo
20 se utilizan en la formación de proteínas a continuación una tabla con los
aminoácidos:
No Esenciales
|
Esenciales
|
Alanina
|
Arginina*
|
Asparragina
|
Histidina
|
Aspartato
|
Isoleucina
|
Cisteina
|
Leucina
|
Glutamato
|
Lisina
|
Glutamina
|
Metionina*
|
Glicina
|
Fenilalanina*
|
Prolina
|
Treonina
|
Serina
|
Triptófano
|
Tirosina
|
Valina
|
Fuente: “Instituto Chileno de
Medicina”. http://www.infojoven.cl
CLASIFICACIÓN DE LOS AMINOÁCIDOS
Aminoácidos proteinogenos
Existen varias posibilidades de clasificar a estos, de
acuerdo con la naturaleza de su radical específico por:
1. Solubilidad: para distinguir aminoácidos polares y
apolares
2. Naturaleza
química de su cadena lateral: para
distinguir si son aromáticos, alifáticos, ramificados, azufrados, hidroxilados,
ácidos y básicos.
3. Glucógenos:
capaces de originar
glucosa o capaces de formar grupos cetónicos
4. Esenciales
o no esenciales: según
tengan o no que ser aportados por la dieta en función de la capacidad de su
síntesis por el organismo.
Aminoácidos
no proteinogenos
Algunos aminoácidos no proteinogenos se originan en el
metabolismo de los aminoácidos proteinogenos, por ejemplo: la ornitina se forma
de la arginina en el ciclo de la urea; el acido gamma- aminobutirico es un
neurotransmisor que se origina por la descaboxiilacion del glutamato, etc.
FUNCIONES DE LOS AMINOACIDOS
Las funciones de los aminoácidos son muy diversas y se
pueden agrupar de la siguiente manera:
Fuente:
“Instituto Chileno de Medicina”. http://www.infojoven.cl
DIGESTIÓN
Y ABSORCIÓN
La digestión de las proteínas comienza
en el estómago, con la intervención de su componente ácido, que tiene en este
caso dos funciones. La primera es la de activar la pepsina de su forma
zimógeno, la segunda, la de favorecer la desnaturalización de las proteínas.
La pepsina es una enzima clave que
inicia el proceso de hidrólisis proteica. Las células de la mucosa segregan
pepsinógeno, y el HCl del estómago estimula la conversión de pepsinógeno en
pepsina. Esta enzima desdobla proteínas y péptidos, en sitios específicos de la
unión peptídica, como el grupo carboxilo de algunos aminoácidos, fenilalanina,
triptófano y tirosina, y quizás, leucina y otros aminoácidos acídicos.
Cuando la proteína, parcialmente
fraccionada, pasa al intestino delgado, las enzimas pancreáticas tripsina,
quimotripsina y carboxipeptidasa A y B son las responsables de continuar su
digestión. Tripsinógeno, quimotripsinógeno y procarboxipeptidasas A y B son las
formas zimógeno de tripsina, quimotripsina y carboxipeptidasa A y B,
respectivamente. Células de la mucosa intestinal segregan la enzima
enteroquinasa, que desdoblará un hexapéptido del tripsinógeno para formar
tripsina activa. Una vez formada, la tripsina puede también realizar una
división hexapéptidica del tripsinógeno, proporcionando más tripsina. Esta
enzima, a su vez, convierte otras formas inactivas de enzimas pancreáticas en
sus formas activas. La tripsina actúa sobre las uniones de péptidos que afectan
los grupos carboxilo de arginina y lisina. Es tambien una endopeptidasa puesto
que escinde péptidos en el interior de la cadena proteica. Quimotripsinógeno es
una endopetidasa. Carboxipeptidasas A y B son consideradas exopeptidasas en
cuanto que escinden aminoácidos del carboxilo final de polipéptidos. Las
aminopeptidasas, que son consideradas unas exopeptidasas, escinden los péptidos
en aminoácidos y oligopéptidos.
La hidrólisis final de los péptidos
producidos por las enzimas pancreáticas tiene lugar en la superficie de las
membranas de los microvilli de las células de la mucosa intestinal. Y en
resumen, el resultado final de la digestión luminal de las proteinas en el
intestino delgado es la obtención de fragmentos de oligopéptidos, dipéptidos y
aminoácidos.
DIGESTIÓN
DE LAS PROTEINAS
Se muestra a continuación un cuadro
sinóptico para que se explique mejor la digestión de las proteínas.
|
|
Fuente: “Instituto Chileno de Medicina”.
http://www.infojoven.cl
METABOLISMO
METABOLISMO DE LOS AMINOACIDOS EN EL ENTEROCITO
Los aminoácidos que llegan al
enterocitos pueden seguir varias vías metabólicas entre las que destacan su
utilización para la síntesis mucosales, intercambio entre ellos, consumo
energético y liberación de sangre portal.
Los
enterocitos utilizan hasta un 10% de los aminoácidos absorbidos en sintetizar
proteínas de secreción, proteínas celulares de recambio y proteínas destinadas
al reemplazamiento de las células perdidas por descamación. Los aminoácidos
luminales son esenciales para los enterocitos.
Las células de la mucosa realizan
también algunas transformaciones en los aminoácidos absorbidos, especialmente
la transaminacion de glutamato y del Aspartato. El Aspartato y el glutamato son
tóxicos para la región hipotalámica para las ratas y ratones. La glutamina es
metabolizada en las células de la mucosa. Se aprovecha así su nitrógeno
amidico, fundamentalmente para las bases puricas. Esta vía es muy activa en
este tejido. La glutamina no procede solo con la absorción sino que también es
extraída del plasma hasta un 25%.
A continuación se muestra un cuadro
para ser más fácil su comprensión:
Fuente: “Instituto Chileno de Medicina”.
http://www.infojoven.cl
METABOLISMO DE LOS
AMINOACIDOS EN EL HIGADO
El hígado juega un papel fundamental
en el metabolismo nitrogenado. Los aminoácidos que llegan por la vena porta
pueden seguir algunas de las siguientes vías:
a)
Pasar
por la circulación sistémica por la vena supra hepática sin metabolización.
b)
Originar
péptidos, proteínas y otros derivados metabólicos nitrogenados como purinas y
pirimidinas, porfirinas, aminoalcoholes, etc. Algunos de estos compuestos,
fundamentalmente ciertas proteínas, serán posteriormente liberadas a la
circulación, como albumina y además de proteínas plasmáticas (prealbumina,
proteína, fijadora de retinol, transferrina, fibrinógeno).
c)
Catabolizarse
para producir energía
PRINCIPALES VÍAS DEL
METABOLISMO DE LOS AMINOACIDOS DEL HÍGADO
Fuente: “Instituto Chileno de Medicina”.
http://www.infojoven.cl
El Ciclo de la Urea
Previamente fue conocido que la
glutaminasa renal era la responsable de convertir el exceso de glutamina del
hígado a amoniaco urinario. Sin embargo, cerca del 80% del nitrógeno excretado
está bajo la forma de urea que también es altamente producida en el hígado, en
una serie de reacciones que están distribuidas entre la matriz mitocondrial y
el citosol. La serie de reacciones que forman la urea es conocida como Ciclo de
la Urea o Ciclo de Krebs-Henseleit.
Las características esenciales de las
reacciones del ciclo de la urea y su regulación metabólica son como sigue: la
arginina de la dieta o del metabolismo de las proteínas es rota por la enzima
citosólica arginasa, generando urea y ornitina. En reacciones subsecuentes del
ciclo de la urea un nuevo residuo de urea es construido sobre la ornitina,
regenerando arginina y perpetuando el ciclo.
La ornitina que se presenta en el citosol
es transportada a la matriz mitocondrial, donde la ornitina transcabamilasa
cataliza la condensación de la ornitina con el carbamoil fosfato, produciendo
citrulina. La energía para la reacción es proporcionada por el anhídrido de
alta energía del carbamoil fosfato. El producto, citrulina, es entonces
transportado al citosol, donde ocurren las restantes reacciones del ciclo.
La síntesis de citrulina requiere una
activación previa de carbono y de nitrógeno como carbamoil fosfato (CP). El
paso de activación requiere 2 equivalentes de ATP y de la enzima carbamoil
fosfato sintetasa-I (CPS-I) de la matriz mitocondrial. Hay dos CP sintetasas:
una enzima mitocondrial, CPS-I, que forma el CP destinado para la inclusión en
el ciclo de la urea, y una sintetasa citosólica CP (CPS-II), que está envuelta
en la biosíntesis del nucleótido de
pirimidina. La CPS-I
es regulada positivamente por el efector alostérico N-acetil-glutamato,
mientras que la enzima citosólica es independiente del acetilglutamato.
En una reacción de 2 pasos, catalizada por la arginino
succinato sintetasa citosólica, la citrulina y el Aspartato son condensados
para formar el arginino succinato. La reacción implica la adición de AMP (a
partir de ATP) al amido carbonil de citrulina, formando un intermediario
activado en la superficie de la enzima (AMP-citrulina), y la adición subsiguiente
del Aspartato para formar arginino succinato.
La arginina y el fumarato son
producidos a partir del arginino succinato por la enzima citosólica arginino
succinato liasa (también llamada arginino succinasa). En el paso final del
ciclo la arginasa se libera la urea del arginino, regenerando ornitina
citosólica, que puede ser transportada a la matriz mitocondrial para otra ronda
de la síntesis de la urea. El fumarato, generado vía la acción de la arginino
succinato liasa, es reconvertido a Aspartato para usarlo en la reacción de la
arginino succinato sintetasa. Esto ocurre a través de las acciones de las
versiones citosólicas de las enzimas del Ciclo del TCA, fumarasa (que produce malato) y
malato deshidrogenasa (que produce oxaloacetato). El oxaloacetato es entonces
transaminado a Aspartato por medio de la AST.
Comenzando y terminando con la
ornitina, las reacciones del ciclo consumen 3 equivalentes de ATP y un total de
4 fosfatos de nucleótido de alta energía. La urea es el único compuesto nuevo
generado por el ciclo; todos los otros intermediarios y reactantes son
reciclados. La energía consumida en la producción de urea es más que la
recuperada por la liberación de la energía formada durante la síntesis de los
intermediarios del ciclo de la urea. El amoníaco liberado durante la reacción
de la glutamato deshidrogenasa esta acoplado a la formación del NADH. En
adición, cuando el fumarato se convierte de nuevo a Aspartato, la reacción de
la malato deshidrogenasa usada para convertir el malato a oxaloacetato genera
un mol de NADH. Estas dos moles de NADH, así, son oxidadas en la mitocondria
produciendo 6 moles de ATP.
METABOLISMO
DE LOS AMINOÁCIDOS EN EL MÚSCULO
La captación muscular de aminoácidos y
su utilización en la síntesis de proteínas es estimulada por la insulina,
mientras que los glucocorticoides tienen efectos opuestos. Después de la
ingestión de alimento, predomina la captación y utilización de los aminoácidos
para la proteosintesis, mientras que en los periodos interdigestivos y en el
ayuno predomina la liberación de aminoácidos con fines gluconeogenos,
destacando los siguientes: Piruvato, Alanina, Glutamina.
Fuente: “Instituto Chileno de Medicina”.
http://www.infojoven.cl
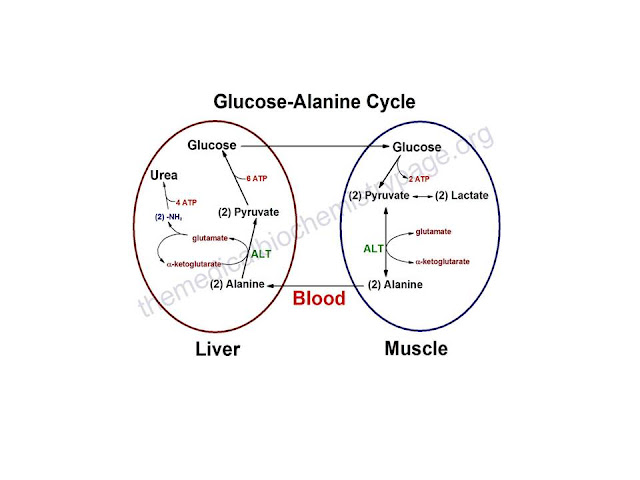
El ciclo de la glucosa-Alanina es utilizado sobre
todo como un mecanismo para eliminar el nitrógeno del músculo esquelético
mientras que se reabastece su fuente de energía. La oxidación de glucosa produce
el piruvato que puede experimentar la transaminación a Alanina. Esta reacción
es catalizada por la Alanina transaminasa, ALT. Además, durante períodos de
ayuno, la proteína del músculo esquelético es degradada por el valor energético
de los carbonos del aminoácido y la Alanina es un aminoácido importante en la
proteína. La Alanina entonces entra en la corriente sanguínea y es transportada
al hígado. Dentro del hígado la Alanina es convertida de nuevo a piruvato que
es entonces una fuente de átomos de carbono para la gluconeogénesis. La glucosa
recién formada puede entonces entrar a la corriente sanguínea para ser
entregada nuevamente al músculo. El grupo amino transportado del músculo al
hígado en la forma de Alanina es convertido a urea en el ciclo de la urea y es
excretado.
En el metabolismo normal de las proteínas se produce
una eliminación ininterrumpida de nitrógeno que equivale a 50 g de proteínas
diarias, que corresponden a una ingesta proteica de 50 g /día. La tasa de
síntesis y degradación de las proteínas es de 300 g/ día. En condiciones de
inanición el catabolismo de las proteínas continua, sin la
correspondiente ingesta de proteínas, por lo que el paciente tendr` un
equilibrio negativo de proteínas. Este proceso se conoce como equilibrio negativo
de nitrógeno.
Durante las enfermedades graves, la tasa de
catabolismo proteico aumenta al mismo tiempo que la ingesta se interrumpe, lo
que provoca un equilibrio negativo de nitrógeno. Durante las enfermedades
graves, los nuevos tejidos, células inflamatorias, factores de la coagulación,
anticuerpos y depósitos de otras proteínas se sintetizan a una velocidad
acelerada. De esta manera los aminoácidos derivados del músculo o de otras
proteínas somáticas o viscerales se convierten en componentes básicos de las
proteínas en el tejido cicatrizal y en las defensas del huésped. Un número
adecuado de las necesidades de proteínas basales es de 1 g/kg/ día o 40
gm2/día.
Los mediadores del catabolismo proteico parecen
diferir de los mediadores del índice metabólico. El factor de necrosis tumoral
es un mediador específico liberado a partir de los monocitos que estimula la
degradación de las proteínas endógenas. Por otra parte un paciente
hipermetabólico catabólica las vitaminas con mayor rapidez que un individuo sano
y puede alcanzar antes un estadio deficitario. Los oligoelementos deben
manejarse con cuidado porque su déficit puede producirse más precozmente y al
mismo tiempo una sobredosis puede ser letal. De esta manera el calcio, fósforo,
magnesio y azufre representan algo más que oligoelementos, estos se pierden
continuamente por la orina, heces, jugos gástricos y otros líquidos de drenaje.
Por tanto los niveles de electrolitos deben determinarse a intervalos
regulares. Los pacientes tratados con alimentación enteral o parenteral durante
más de dos semanas deben recibir suplementos de Cinc, cobre, cromo, selenio y
magnesio.
METABOLISMO
PROTEICO
|
1 g de nitrógeno =
6,25 g de proteínas
|
Perdidas de
nitrógeno: 5-10 g/dia, 85% como urea
|
Tasa metabólica proteica
|
|
Normal: O,5-1 g/kg/ día
|
|
Hipermetabólica = 1,5-2 g/kg/ día
|
|
Fuente: Metabolismo y las Reservas
energéticas. http://www.puc.cl.
RESERVAS ENERGÉTICAS
Y PROTEICAS
El
estado nutricional de un individuo es posible establecerlo mediante la determinación
del peso corporal en relación con la talla. Las reservas energéticas se
calculan en términos de la cantidad de grasa corporal. Para la medición de la
reserva energética se calcula el equilibrio calórico. El gasto energético en
reposo diario se calcula combinando datos de la edad, sexo, peso y talla. La
ingesta energética diaria se calcula a partir del valor calórico de los
nutrientes ingeridos por día.
En
un paciente en estado crítico, un déficit de 10, 000 calorías es un déficit
energético agudo, grave, aunque solo representa unos 5-6 días de
semi-inanición. Las reservas de grasa pueden calcularse determinando el espesor
de pliegue cutáneo tricipital o examinando los cambios del peso corporal
corregidos para el equilibrio hídrico.
En
relación con las reservas de proteínas, tenemos que la mayor parte de las
técnicas de evaluación nutricional son estimaciones de las reservas proteicas
del organismo. El índice
de creatinina/talla es una determinación de la cantidad de
creatinina excretada ajustada al tamaño corporal. Los músculos constituyen la
fuente principal de proteínas endógenas, en consecuencia la consunción muscular
es característica de los estados de desnutrición. La determinación de la capacidad
respiratoria máxima es uno de los exámenes musculares
utilizados para la evaluación nutricional. En este examen se determina la
cantidad máxima de aire que puede movilizarse por medio de una respiración
rápida durante 12 segundos. Los valores se expresan como el porcentaje de la
cantidad predicha para una edad, sexo y talla determinados (normal: 80-120%).
El
equilibrio de nitrógeno real se determina midiendo la cantidad de nitrógeno
excretado. Se realiza determinando la cantidad de urea excretada en la orina,
suponiendo que la urea constituye el 85% de la excreción total de nitrógeno.
Las
evaluaciones indirectas de las reservas proteicas se basan en la determinación
individual de sustancias corporales que depende de una síntesis proteica rápida
para el mantenimiento de niveles normales. Los niveles de proteínas séricas
como albúmina y globulinas no están afectados por la desnutrición hasta que
esta se convierta en desnutrición grave. Los niveles de proteínas como
prealbumina y transferrina, cuyo recambio es más rápido son mejores indicadores
del estado proteico. Los linfocitos se destruyen rápidamente y las proteínas
son necesarias para la formación de nuevas células. El recuento absoluto de
linfocitos representa un parámetro útil del estado de las reservas de
proteínas. Las proteínas son necesarias además para sintetizar las células y
mediadores relacionados con las pruebas de reactividad cutánea.
INGESTA DIARIA
RECOMENDADA DE PROTEÍNAS:
|
Lactantes: 1,6-2,2 g/Kg
peso/día
|
Niños: 1-1,2 g/Kg peso/día
|
Adolescentes (chicos): 0,9-1
g/Kg peso/día
|
Adolescentes (chicas): 0,8-1
g/Kg peso/día
|
Adulto: 0,8 g/Kg peso/día
|
Deportistas entrenados: hasta 3
g/Kg peso/día
|
Gestación (2ª mitad): + 6
gramos diarios
|
Lactancia (1-6 meses): + 15
gramos diarios
|
Lactancia (superior a 6 meses):
+ 12 gramos diarios
|
Fuente: Los Ciclos de la vida.
Aunque se
recomienda que estas proteínas provengan de variedad de alimentos, hay
múltiples razones para elegir en mayor proporción las de origen vegetal, entre
las que destacan su precio (sensiblemente inferior) y su aporte escaso o nulo
de grasas saturadas y de colesterol.
FUENTES ALIMENTARIAS
Los
alimentos como la carne, huevo, pescado, la leche y los productos lácteos,
donde estos nos dan un 65% de la proteína, los de origen vegetal ricos en
proteínas son las leguminosas la soya, cacahuate, frijoles, lentejas solo nos
dan el 18%. Los cereales contienen menor proteína el 3%, las frutas y verduras
7 a 8%.
3.8
ARTÍCULO: “FÍSTULAS Y SU NUTRICIÓN”
Una fístula es una comunicación
anormal entre dos partes internas del cuerpo. Las fístulas pueden ser
consecuencia de una lesión, una infección o una inflamación.
¿DONDE LA ENCONTRAMOS?
|
Fuente:
Fistulas Enterocutánea y su Tratamiento Integral.
TIPOS
DE FÍSTULAS
¿QUÉ
ES UNA FÍSTULA ENTEROCUTÁNEA?
Es una vía
indeseable desde el intestino a otros órganos. Se puede dar por:
FASES
DEL MANEJO DE LAS FÍSTULAS
1.
Fase I. De Estabilización
a)
Corrección
de los desórdenes de líquidos y electrolitos y en el equilibrio ácido-base.
b)
Reposo
intestinal con suspensión de la vía oral y el uso de succión nasogástrica si
está indicada
2.
Fase
II. De estudio diagnóstico
En la que se identifica el sitio y
características anatómicas de la fístula a base de:
a)
Estudios
Radiológicos con uso de catéteres finos y medios contrastados hidrosolubles
(fistulografía),
b)
y
estudios balitados (tránsito intestinal, colon por enema).
3.
Fase
III. De selección de un modelo eficaz de apoyo nutricional y definición del momento oportuno para realizar
un cierre quirúrgico.
a)
Estudio
de la fistula: Ubicación. Lateral o terminal. Trayecto. Obstrucción distal.
Intestino adyacente. Patologías asociadas a esta.
b)
Evaluación
de la evolución: 6 -8 semanas
TRATAMIENTO
NUTRICIONAL
La
selección del método de nutrición dependerá de:
RECOMENDACIONES
DIETÉTICAS Y NUTRICIONALES
a)
Energía:30 kcal/kg/día
b)
Proteínas 1.5 - 2 grs/kg
c)
Lípidos: 1 a 1,2 gr/kg/día.
d)
Carbohidratos
se ajustan después de sacar los anteriores
e)
Vitamina C. HOMBRES 84mg, MUJERES 75mg
f)
Zinc. HOMBRES 15mg, MUJERES 11mg
g)
Dar
una dieta baja en residuo, blanda o normal según tolere el paciente.
h)
Procurar
que los alimentos se encuentren a una temperatura ambiente.
i)
Valorar
el estado de hidratación en el que se encuentra el paciente.
j)
Si
se está administrando soporte nutricional por sonda tener los cuidados
necesarios.
Recordemos
que la nutrición es una parte importante para la recuperación del paciente y
evitar complicaciones.





No hay comentarios:
Publicar un comentario